Flash放疗是利用超高剂量率辐射进行的一种放射治疗方法,其相对于传统剂量率的放射治疗,有着其独特的放射生物学优势。
对Flash放疗相关的原理,对生物实验的过程与结果进行了相关的总结归纳。同时分析了Flash放疗的优势与面临的挑战,并对未来的临床应用进行了展望。
0 引言
放射治疗作为癌症的主流治疗方式之一,带给患者的是喜忧参半。放疗能够有效杀死肿瘤细胞,但同时对周围危及器官的损伤及其给患者带来的副作用也是不可避免的。
而放疗的最终目的是在实施处方剂量下能够有效杀死癌细胞,并尽可能地减少对周围危及器官的损伤。针对于此,研究人员提出了一种新型的放疗技术方法,即Flash放疗。
1 Flash放疗简介
Flash放疗是一种新型的无创外照射放疗技术,通过超高剂量率(约≥40Gy/s)输送超高剂量的射线,能够拓宽患者的治疗窗,显著改变放疗及肿瘤治疗的格局。
与常规剂量率(1~7cGy/s)放疗相比,Flash治疗可在极短时间(不到1s)内输送高于8Gy的照射剂量,剂量率超过50Gy/s。
研究人员认为,高剂量率的照射会导致组织中的氧气耗竭,使健康组织产生辐射抵抗,从而能够在高缺氧的条件下实施破坏肿瘤组织的剂量递增治疗。
换言之,健康组织能够更好地耐受这种照射方式,而肿瘤对Flash照射的敏感性与传统治疗相同。
Flash效应于1959年首次被观察到,BEWLEY等在1971年研究发现当剂量率(6000rad/min)高到可以降低氧分压时,辐照会降低对小鼠正常组织的伤害,并且证实高剂量率电子束确实会引发组织缺氧情况的出现。
1974年通过观察大鼠皮肤在不同剂量率条件下对7MeV电子辐照的反应,研究者发现当剂量率从70rad/min提高至500rad/min时,辐照明显降低了处于有氧条件下大鼠的毒副作用。
2014年,FAVAUDON等[1]进一步揭示了小鼠正常组织和肿瘤组织对高剂量率的差异性反应。随着研究的深入,Flash效应的研究也逐渐深入到不同物种及不同器官等,但是到目前为止,国内相关研究仍是一片空白。
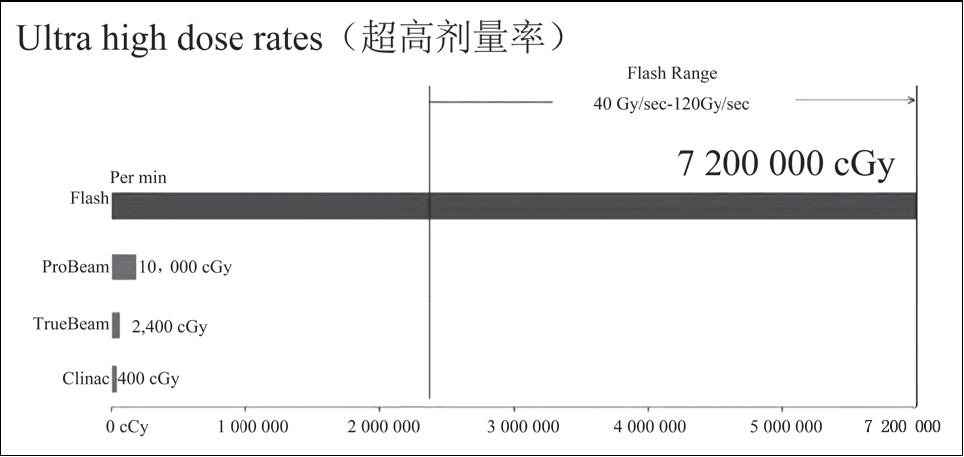
图1 常规光子、质子及Flash放疗剂量率对比
传统的放疗是建立在经典的放射生物学“4R”理论之上,即放射损伤再修复(Repair)、再氧合作用(Reoxygenation)、细胞周期再分布(Redistribution)与细胞再增生(Repopulation)。
对于Flash治疗的原理,其放射生物学机制非常复杂。
目前,有两种主要的解释:研究者在20MeV的小鼠模型中证实,在非常高的剂量率下,正常细胞组织损伤降低,这种影响归因于氧的消耗。在非常高的剂量率下,高剂量会很快耗尽氧气,使其扩散,以维持足够的氧合水平,正常组织会作为缺氧组织给予反应。
因此,超高剂量率会耗尽氧气,模拟缺氧,从而增加组织的抗辐射能力。在缺氧(抗辐射)肿瘤被氧化正常组织(放射敏感性)包围的情况下,超高剂量率会增加正常组织的抗辐射性,对已经缺氧的肿瘤组织的影响很小。
然而,大多数旨在研究这些技术增加剂量率影响的实验都没有发现显著的效果。理想情况下,任何体外研究都应该使用生理相关的氧气水平。
对DNA等分子的间接损伤主要是羟基自由基(OH),但是细胞内的高活性环境限制了它们的寿命小于10-8s,因此它们的扩散距离约为6~9nm。
即使对于具有ps脉冲的激光加速质子超过50Gy的剂量也有必要看到对自由基产量的影响。
因此,很难想象化学阶段能被快闪辐射的剂量率所改变。即使这些论据中的大多数适用于体外实验,而没有模拟氧气效应。
另一种替代解释是染色质的重塑是由多聚腺苷二磷酸核糖聚合酶介导的,或者炎症/抗炎细胞信号可能依赖于整个治疗时间。
循环血细胞的部分受到辐射,因此比传统剂量辐照更能保护免疫系统。循环血淋巴细胞的染色体畸变确实强烈依赖于照射量和辐照时间。
在Flash照射中,时间的减少将使更多的循环免疫细胞得以存活。在这种情况下,分割照射方式的放疗疗效会消失。
由于Flash放疗机制尚不清楚,上述论述还有待其他研究人员进一步证实。
3 Flash放疗的临床应用
Flash放疗需要超高剂量率来实现,目前临床上还没有一套完整的设备来实现超高剂量率。临床上大多超高剂量率的设备实现是通过改进传统放疗设备达成的,如表1所示。
表1 目前已开展的Flash照射实验

HARRINGTON以一种改造的方法使用临床医用直线加速器进行Flash实验,通过增加枪电流和微波功率以提高剂量率,其改装后的1cm深度处剂量率能够达到之前的40倍之多,最高可达到900Gy/s,从而确定了机器头部位置提供高剂量率辐照,比低剂量率更均匀的优点。
PATRIARCA等团队通过使用一套商业临床质子治疗系统进行Flash实验,将一台230MeV质子回旋加速器的质子束传送到2个被动式照射治疗室和一个“通用”喷嘴式机架治疗室,获得了剂量率超过40Gy/s的超高剂量率的质子束流。
近年来,这些通过改进传统放疗设备获得超高剂量率射线的实验,为Flash放疗提供了临床应用的基础。
LOO等基于超高剂量率进行了小鼠腹部照射实验,实验结果初步证明了Flash照射比常规照射有着更高的存活率,PAULINE等[3]实施了猫的鳞状上皮细胞癌的Flash放疗,与常规治疗相比没有出现急性毒性反应,也证实了Flash治疗的潜在优势。
Flash放疗的速度及特性使得其成为理想的肿瘤治疗方法,尤其对于需运动管理的肿瘤放疗而言更为重要。
例如,对于肺癌,传统放疗需要将束流照射与呼吸周期同步,以实现在特定的位置对运动中的肿瘤实施精确放疗。
LOO等研究表明,如果放疗过程几乎只在一瞬间,那么就相当于“冻结”了体内所有的运动。这样就能够最精准、高适形性地照射肿瘤,同时充分利用了Flash放疗的生物学优势,以保护正常组织。
4 Flash治疗的最新进展
相关Flash的研究项目,目前主要集中在粒子治疗系统领域中;若要用于光子放疗领域,目前面临的最大的问题是工程实现和安全保障这两大超级难题。
2018年10月瓦里安在第60届ASTRO年会上发布ProBeam360°单室质子治疗系统,未来可实施Flash放疗。
同日由瓦里安牵头联合13家成员单位专注于超高剂量率癌症质子治疗的美国能源部(DOE)SLAC国家加速器实验室和斯坦福大学宣布获得约270万美元科研基金的资助,用于推进高速X线和质子照射技术的研发。
这项高速照射技术基于SLAC/斯坦福团队共同研发的新型加速器,能够将治疗时间由数分钟缩短至1s以内,可精准照射肿瘤靶区,降低正常组织的损伤风险,减少放疗副作用。
其中X线Flash照射系统的研发项目——PHASER(pluridirectional high energy agile scanning electron radiotherapy),它的新型加速器结构更加紧凑并且提供的能量是现有加速器的成百上千倍。
目前团队已经研发并测试了加速器原型,模拟结果显示加速器原件的运行状态符合设计要求。
预计3~5年内设计出第一台可用于临床试验的设备,PHASER项目的紧凑型设计可将治疗设备置于标准集装箱内运输,增加全球放疗资源的可用性。
除了常规X线Flash项目外,SLAC/斯坦福团队同时在进行高速质子治疗技术的研发。
新型质子加速器的结构与PHASER项目的加速器相似,能够瞬间输送高剂量的质子束,使质子治疗更简单、设备更紧凑、治疗速度更快。
2019年3月荷兰格罗宁根大学医学中心(UMCG)在IBA旋转机架治疗室实施了首次Flash照射。
该中心拥有两间质子治疗室,ProteusPLUS在其中一间治疗室的等中心点位置实现了数次Flash照射。
系统实验结果显示,剂量率最高达到200Gy/s,大幅超过Flash照射所需的剂量率。
2019年4月,马里兰质子治疗中心以及瓦里安共同发布了首例应用临床设备的Flash放疗临床前研究结果,显示Flash放疗与常规放疗相比可减少25%~30%的肺组织损伤,从而减少了肺部纤维化的发生,放射性皮炎发生率平均减少了35%。
2019年6月英国Rutherford癌症中心实施了在IBA ProteusONE紧凑型质子治疗室的首次Flash照射,剂量率最高达到173Gy/s。
2019年7月瑞士洛桑大学医院为一例皮肤淋巴瘤患者实施了Flash放疗,这是全球首例人体Flash治疗。
其使用的治疗设备是位于洛桑大学医院的Oriatron eRT6直线加速器,在此前已用于临床实验猫和实验猪的治疗。治疗的处方剂量为15Gy,共10个脉冲,每个脉冲1ms。
实验结果表明,Flash放疗具有理想的疗效,并可保护正常的皮肤。这项技术在临床上是安全可行的。
2019年10月,瓦里安与辛辛那提儿童医院医疗中心/辛辛那提大学医学中心质子治疗中心共同宣布,在Flash放疗临床试验道路上取得重大进展。
联合研究小组利用瓦里安Probeam质子治疗旋转机架治疗室的科研模式,成功地完成了对模体靶区的Flash照射。
该试验是世界上首次使用质子系统进行肺部立体定向体部Flash放疗。
5 Flash放疗的潜在缺陷
对高剂量率照射后DNA初始损伤的分布分析表明,大剂量率照射后DNA损伤的分布向严重损伤方向转移,分布范围变宽。因此,增加剂量率及改变超快电子的脉冲频率会增加DNA损伤的复杂性,从而降低其可修复性。
DNA的修复方式有三种:基底切除修复、核苷酸切除修复及不匹配修复。
研究人员研究了4MeV电子束辐射超短脉冲对人体细胞DNA损伤和修复的剂量率效应。
在LDR和HDR两种模式下以相同实验条件的照射结果表明,通过改变脉冲频率以增加剂量率会导致DNA损伤的复杂性增加,从而降低它们的可恢复性。
6 Flash放疗面临的挑战
就目前的研究结果来看,Flash放疗仍面临的许多挑战。
其一,缺乏实施Flash放疗的系统。放疗中深部肿瘤需要应用非常高能量的电子、X线或质子Flash放疗;还需要开发出一套综合性剂量监测系统;当照射如此高的剂量率时,安全尤为重要。为了保证治疗有效,需要高精准的图像引导设备实时跟踪靶区[24]。
其二,尽管临床研究是一个很好的开端,但某些发表的研究缺乏必要的相关信息。此类研究应包括放射生物学实验,以明确前期实验结果可在不同环境下重复,并评估潜在的长期影响,通常关注的只是放疗过程中和放疗刚结束后出现的急性毒性反
应,但对于导致迟发并发症的机制,仍完全不明确。
其三,分次问题也是需要进一步探究的领域,是否需要分次和在1s内、采用单分次完成治疗时,必须确定治疗照射剂量的正确。
其四,治疗设备也是限制Flash放疗的一个因素,目前直线加速器无法在要求速率下实施照射剂量。LOO等正在美国SLAC国家加速器实验室合作展开PHASER项目,融合多项技术研发新型加速器,旨在实现高速照射。
其五,财政因素也是一个限制Flash放疗的一个原因。降低技术成本,设备更经济、更紧凑,并且与现有的设施兼容是至关重要的;该系统也应具备更高的自动化和临床效率,这样能够在特定的时间内治疗更多的患者。
7 总结
综上所述,Flash放疗具备巨大的潜力,有望成为一种新型的放疗手段,给癌症的治疗带来革命性的改变。虽然目前还无法弄清其放射生物学机理,也缺乏独立的实验结果和研究平台,距离临床日常应用的Flash放疗还有很长的路要走,但这项技术的研发已取得了很大的进展,包括在开展人体临床试验方面。
由于目前还处于起步阶段,实现Flash放疗临床常规应用需要研究人员的一点一滴的积累,相信随着研究人员的努力,以及越来越多的人员加入其中,Flash放疗将会让肿瘤治疗进入一个新的阶段。


